加速正畸牙齿移动技术的研究新进展
加速正畸牙齿移动技术的研究新进展
作者简介
陈莉莉,教授、主任医师、博士研究生导师。现任华中科技大学同济医学院副院长,华中科技大学同济医学院口腔医学院党委书记、院长,口腔颌面发育与再生湖北省重点实验室主任,口腔颌面医疗器械和装备湖北省工程研究中心主任。兼任中国医师协会口腔医师分会副会长,中华口腔医学会全科口腔医学专业委员会候任主任委员,《中华口腔正畸学杂志》副总编辑,《中国实用口腔科杂志》副主编。主持国家杰出青年科学基金项目、国家自然科学基金重点项目、重大国际合作项目、区域联合重点项目等国家及省部级科研项目30余项。获“全国创新争先奖”、“中国青年女科学家奖”、“国家杰青”、“教育部长江学者”、“十四五重点研发计划”首席科学家及国家“万人计划”领军人才等。以第一完成人获湖北省科技进步奖一等奖2项,华夏医学科技进步奖一等奖1项。
作者姓名:孙纪威,张 曼,唐清明,陈莉莉
基金项目:科技部重点研发计划(2021YFC2400400/04);湖北省重点研发项目(2020BCA072)
作者单位:华中科技大学同济医学院附属协和医院口腔医学中心,湖北 武汉430022;华中科技大学同济医学院口腔医学院,湖北 武汉 430030;口腔颌面发育与再生湖北省重点实验室,湖北 武汉 430022
通信作者:陈莉莉,电子信箱:chenlili1030@hust.edu.cn
摘要:错𬌗畸形是口腔颌面部最常见的发育异常性疾病,其临床患者尤其是成年患者,因牙槽骨代谢及改建缓慢,正畸疗程可长达数年且效果不佳,常易引发如牙根吸收、牙齿松动、骨开窗及骨开裂等并发症,严重影响患者身心健康。近年来,国内外研究人员为提高牙槽骨改建效率而研发了一系列临床加速正畸牙齿移动技术,主要包括外科干预、药物干预及物理刺激三大类。文章系统阐述加速正畸牙齿移动技术的研究新进展,并对其原理进行总结,为研发新型高效加速正畸牙齿移动技术、优化临床治疗策略提供可靠的参考和帮助。
关键词:错𬌗畸形;口腔正畸学;加速正畸牙齿移动技术;牙槽骨改建;牙移动效率
第四次全国口腔健康流行病学调查报告显示,我国错𬌗畸形患病率高达74%[1],医疗成本高,对我国社会经济及人民健康造成了巨大的影响。成年患者生长潜力有限,组织反应慢,其正畸治疗一般需持续3 ~ 5年[2];冗长的治疗周期大大增加了罹患并发症的风险,易伴发如龋齿、牙根吸收、牙齿松动、骨开窗、骨开裂等常见并发症[3-4];同时,长期佩戴托槽及弓丝等矫治器影响患者的颜面美观,进而影响患者的心理健康及社交活动。因此,开发新型加速正畸牙齿移动技术,安全高效地提升正畸牙移动效率,缩短疗程,降低并发症,具有重要的意义。
目前,临床常见的加速正畸牙齿移动技术包括外科干预、药物干预及物理刺激。外科干预包括浅表的骨膜微创及深部的皮质骨切开/材料充填植入,对牙齿移动起到了一定的促进作用,但会对患者造成明显的手术创伤。药物干预包括使用激素类药物及细胞因子,其疗效个体差异较大,存在产生全身副反应的风险,应用普及有一定困难。近年来,声、光、热、电等物理刺激疗法被逐步证实对提高牙周组织代谢、调控成骨/破骨平衡具有积极作用,其中以磁场、近红外光为代表的物理刺激手段作为一种新兴的加速正畸牙齿移动技术,具有安全无创、精准可控等独特优势,临床推广应用前景广阔。本文将归纳总结不同类型的加速正畸牙齿移动技术,评估其对提高正畸治疗效率的价值和未来临床转化的应用前景,为研究及开发高效可靠的加速正畸牙齿移动技术提供参考。
1 外科干预
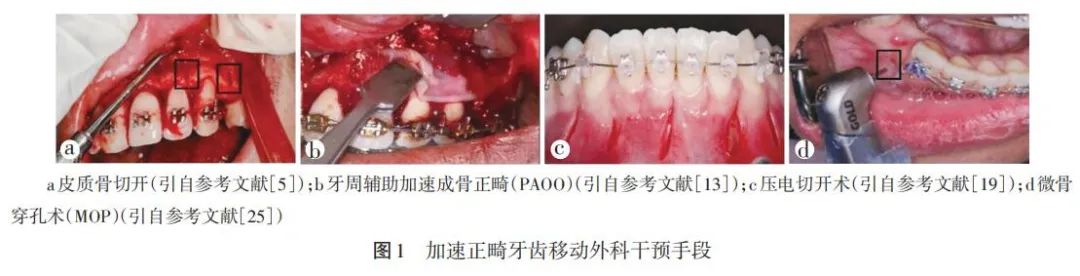
外科干预是最早的加速正畸牙齿移动技术,其采用局部手术对牙周组织产生有创刺激,通过局部骨加速现象(regional acceleratory phenomenon,RAP),促进正畸牙齿的移动。根据手术方式及范围的区别,外科干预技术分为皮质骨创伤术和骨膜微创术两大类。
1. 1 皮质骨创伤术 利用翻瓣操作,暴露待移动牙上方的皮质骨,并开展局部有创刺激及充填物植入,借由皮质骨创伤-修复过程来加速牙周局部改建及牙齿移动的手术方案,在临床上统称为皮质骨创伤术,包括皮质骨切开和牙周辅助加速成骨正畸(periodontally accelerated osteogenic orthodontics,PAOO)。
皮质骨切开(图1a)采用翻瓣暴露颊侧或舌侧皮质骨,在保留骨膜及松质骨血供完整的情况下,通过高速手机或超声骨刀离断牙槽嵴顶、根尖及两者连线近远中部位的皮质骨,从而实现局部有创刺激[5]。基于外科创伤促进骨改建理论[6],研究人员开展了相关临床研究。Kumar等[7]研究发现,接受皮质骨切开的正畸患者在治疗第1、2、3、4个月的牙齿移动距离分别是对照组的1.15、1.22、1.27、1.34倍,提示皮质骨切开可能在正畸治疗的前中期起到了持续加速正畸牙齿移动的效果;相较于其他微创手术操作,Agrawal等[8]研究发现,皮质骨切开组的尖牙移动绝对量为(2.76 ± 0.20)mm,明显高于对照组的(1.50 ± 0.50)mm;Abbas等[9]也证实,接受皮质骨切开的正畸牙齿移动速率比对照组提高近2倍,是所有有创手术中效果最显著的。皮质骨切开刺激了局部软硬组织修复重建活动,使局部破骨效应增强,术区牙槽骨发生暂时性脱矿,骨密度降低,为快速牙移动提供了充足空间[10-11]。由于手术方案及操作的差异,皮质骨切开术的临床疗效目前仍存在争议,如Fernandes等[12]认为皮质骨切开术未能获得足够的正畸牙齿移动增量。同时,因其手术创伤较大、影响颜面美观,患者接受度较低,且易引发牙根吸收、牙槽骨吸收、附着龈减少等并发症,目前暂未得到广泛的临床应用。
PAOO技术(图1b)将皮质骨切开和牙槽骨增量两种技术相结合,翻开牙龈全厚瓣,在待移动正畸牙下方的牙槽骨中选择性植入骨充填材料,以期加速牙槽骨代谢改建[13]。Wang等[14]利用PAOO技术干预常规正畸患者,发现其可将传统正畸治疗周期缩短(6.68 ± 1.64)个月;同样,在接受正畸-正颌联合治疗的重度错𬌗畸形患者中,PAOO可使骨性Ⅲ类错𬌗手术患者的正畸治疗时间平均缩短半年以上[15]。Vannala等[16]和Kamal等[17]也通过Meta分析证实PAOO技术加速正畸牙移动的效果得到了多项研究支持,其作为一种新兴技术,在正畸辅助治疗中具有潜在开发价值。PAOO通过募集和激活牙槽骨中的巨噬细胞,产生大量炎性因子,激活破骨过程来加速正畸牙齿的移动[18]。PAOO技术适用于伴发牙槽骨缺损的正畸患者,但对于伴有活动性牙周病及严重牙龈退缩的患者则存在一定风险,这使得其适用范围受到限制。
1. 2 骨膜微创术 除皮质骨创伤术外,利用微创手术技术对牙槽骨骨膜形成浅表创伤,激发骨组织局部修复改建潜能以促进牙槽骨改建及牙齿移动的技术,归纳为骨膜微创术。依据手术实施方案的差别,骨膜微创术又分为压电切开术和微骨穿孔术(micro-osteoperforation,MOP)。
压电切开术(图1c)指在局麻条件下,在邻间牙乳头基部下方2 ~ 3 mm的牙龈或牙槽黏膜处打开软组织及下方骨膜,利用电刀切割产生深度为2 ~ 3 mm的创口以刺激牙槽骨改建[19-20]。Patterson等[20]和Charavet等[21]研究显示,施用压电切开侧的牙齿移动速率比对照侧高37%,总正畸治疗时间显著缩短43%,证实压电切开对正畸牙移动有促进效果;在为期3个月的追踪调查中,Alqadasi等[22]证实施用压电切开术可获得(2.55 ± 0.94)mm的尖牙移动量,效果优于微创手术,接近皮质骨切开,提示其具有作为传统手术的替代方案、减小患者痛苦和创伤的应用潜力。但是,Hoffmann等[23]通过对以往研究的整合分析,发现只有少量证据支持压电切开术可显著加速正畸牙齿的移动,这可能是由于压电切开所使用的参数及部位在不同研究中存在较大差异。压电切开作为微创外科刺激,可激活牙槽骨微环境内炎症反应,招募破骨细胞聚集,以加速正畸牙齿的移动[6]。压电切开术作为一种微创手段,可在有效降低手术创伤及对患者美观造成影响的前提下,替代传统手术治疗方案来加速正畸牙齿的移动,但其应用的最佳参数仍有待进一步探索;另外,压电切开术存在遗留瘢痕组织的风险,对高位笑线患者的术后美观可能造成影响,还易引发牙根吸收等并发症[24],其临床推广应用仍存在许多挑战。
MOP(图1d)是一种微创手术技术,在避免翻瓣及损伤牙根的基础上,在每个牙根间隔直接穿过黏膜对骨皮质进行微穿孔,孔深3 ~ 4 mm、直径约1.5 mm[25]。Tsai等[26]对接受正畸治疗的大鼠施行MOP干预,在相同时间内获得了相较于对照组1.5倍的牙齿移动距离;Kim等[27]通过优化MOP应用方案,将大鼠正畸牙移动效率提高了32%。Asif等[28]在临床治疗中每4周进行一次MOP干预,将患者尖牙移动速率提高了37.6%。然而,Fattori等[29]及Aboalnaga等[30]却发现MOP组牙齿移动速率与对照组相比仅轻微上调[总移动距离差异为(0.06 ± 0.70)mm,总移动速率仅提高0.058 mm/月],差异无统计学意义。为解释这一矛盾现象,Thomas等[31]及Haliloglu-Ozkan等[32]对MOP临床效果进行了系统分析,发现在术后1 ~ 1.5个月,牙齿移动效率上调最为显著,可达对照组1.5倍以上,这说明MOP的效果在术后早期最为显著,在正畸疗程中周期性反复施用MOP有望维持其加速牙齿移动效果。MOP以较小的手术损伤产生局部刺激,将破骨细胞前体细胞募集到损伤部位,增强待移动牙齿周围牙槽骨的破骨活动,从而加速正畸牙齿的移动[11]。该技术创伤小、患者接受度较高,但其加速正畸牙齿移动的效果及稳定性有待提高,存在如牙根吸收、牙髓活力降低等副反应,同时其手术穿刺部位、深度、方向、直径等尚无统一标准。
2 药物干预
2. 1 激素类药物 甲状腺激素(thyroid hormone,TH)可有效加速全身组织和细胞的代谢活动,被认为有促进正畸牙移动的潜能。Seifi等[33]利用大鼠正畸模型,证实黏膜下注射TH可明显提高正畸牙齿平均移动速率;在临床病例报告分析中,Berry等[34]也发现超过半数的TH使用者实现了牙移动速率的提升。TH可通过刺激前列腺素E2分泌来增加破骨细胞活性,从而对正畸牙移动产生直接作用;同时,TH也可增加骨代谢相关细胞因子,如胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)和白细胞介素(interleukin,IL)-1β等的分泌来调控牙槽骨破骨行为,加速正畸牙移动[35]。
甲状旁腺激素(parathyroid hormone,PTH)是甲状旁腺主细胞分泌的碱性单链多肽类激素,其主要功能是维持体内钙和磷的代谢稳态,可参与调节破骨细胞的数量与功能。Lu等[36]在大鼠正畸模型中证实PTH干预组的牙齿移动距离[(0.81 ± 0.04)mm]明显大于对照组[(0.46 ± 0.05)mm];Li等[37]则通过对新西兰白兔实施PTH间断皮下注射,发现大剂量PTH可有效加速正畸牙齿移动。PTH对于牙槽骨局部血管化及破骨行为有积极作用,可通过上调β-连环素(β-catenin)的蛋白表达、促进核因子-κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)和IGF-1的分泌及募集破骨细胞趋化等方式,增强牙周组织的破骨活动[36-37]。
2. 2 骨改建相关细胞因子 RANKL为B淋巴细胞分泌的调节破骨细胞分化及激活破骨活动的关键细胞因子。Li等[38]及Chang等[39]分别通过小鼠和大鼠正畸模型,证实局部注射RANKL可有效促进牙齿移动,增量高达29.2%。然而,目前尚缺乏临床试验证据来进一步证实其有效性。RANKL可诱导破骨细胞从破骨前体细胞中分化,其不仅调节破骨细胞末端分化,也是破骨细胞骨吸收功能的重要调节因子[40]。
富血小板纤维蛋白(platelet-rich fibrin,PRF)是继血小板血浆之后的第2代血小板制品,包含各类细胞因子及生长因子,有利于细胞增殖、分化、黏附等,对组织改建有积极作用。通过向待移动正畸牙的下方牙龈内注射PRF,Karakasli等[41]及Gupta等[42]均发现受试者的尖牙移动速率比对照组提高近1倍[(2.37 ± 0.56)mm/月vs.(1.32 ± 0.16 mm)/月;(0.50 ± 0.11)mm/月vs.(0.30 ± 0.06)mm/月)]。在机制层面,Erdur等[43]发现局部注射PRF的牙槽骨中IL-1β、基质金属蛋白酶8及RANKL含量显著增加,骨保护素表达量有所减少,提示其可配合正畸机械力刺激来激活局部破骨行为;同时,PRF可影响成骨细胞迁移、增殖和分化,促进新骨形成和愈合,对于牙移动后骨重塑可能同样发挥积极作用[44]。
3 物理刺激
3. 1 低强度脉冲超声干预 低强度脉冲超声(low-intensity pulsed ultrasound,LIPUS)通过脉冲振动给予局部组织低强度、无创的物理刺激,上调牙周组织局部代谢水平,以提高正畸牙移动效率。Xue等[45]通过动物实验证实LIPUS可将大鼠牙移动速率较对照组提升45%以上;El-bialy等[46]通过临床干预及观测,证实LIPUS刺激下的第一磨牙牵拉移动效率较对照组提升达29%。然而,Qamruddin等[47]却在为期7个月的追踪调查中发现患者尖牙移动速率未得到明显提升;同时也有学者提出应用LIPUS会引起细胞毒性水肿、局部血管扩张及角质层损伤坏死,其安全性及有效性仍需要深入探索[48]。在LIPUS干预条件下,如IL-8、成纤维细胞生长因子(fibroblast growth factor,FGF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)等血管新生相关细胞因子分泌明显提高,提示LIPUS促进牙周局部血运活动[49];与此同时,破骨相关的RANKL通路与成骨相关的BMP2通路均受到LIPUS调节而得到激活,说明LIPUS可能全面增强成骨-破骨改建过程,进而促进正畸牙槽骨重塑[45]。作为最先得到美国食品药品监督管理局(FDA)批准的非侵入性正畸辅助加速技术,LIPUS目前已在临床得到了一定的推广。然而,其疗效在不同报道中存在较大差异,仍需要进一步的研究来探索其适应证及应用策略。
3. 2 低强度激光干预 低强度激光治疗(low level laser therapy,LLLT)是指使用波长为600 ~ 1000 nm的单色可见红光或近红外光对组织局部开展物理干预的治疗技术,其操作便捷无创、精准可控,受到正畸辅助治疗领域的关注。Baser Keklikci等[50]发现405 ~ 940 nm范围内的多波段近红外光源均可获得加速大鼠正畸牙移动的效果;Hsu等[51]将照射剂量从750~15 000 J/cm2设置梯度,同时划分了不同的应用频率,证实LLLT对牙移动的促进效果具有剂量和频率依赖性,在安全范围内,高频高剂量LLLT干预可获得最佳效果;Suzuki等[52]进一步发现LLLT显著提高手术辅助治疗效率,LLLT联合手术治疗可将牙移动速率提高1.78倍。基于动物实验的结果,研究人员进一步开展了临床研究。Zheng等[53]将12例需拔除上颌第一前磨牙的正畸患者分为LLLT组和对照组,发现LLLT组在接受正畸治疗28 d内的牙齿总移动量[(1.15 ± 0.29)mm]显著高于对照组[(0.85 ± 0.23)mm];Farhadian等[54]及Pérignon等[55]经过长达数月的临床观察,发现LLLT组的尖牙移动速率比对照组分别增加了60.8%和38.4%,LLLT干预下的牙齿总移动距离[(2.27 ± 1.50)mm]明显大于对照组[(1.64 ± 1.30)mm],同时达到Ⅰ类咬合的速率[(1.0 ± 0.7)mm/月]也显著高于对照组[(0.7 ± 0.6)mm/月]。然而,Mistry等[56]及Heravi等[57]研究却发现,LLLT对于患者尖牙移动并没有显著作用,提示其疗效与应用参数密切相关。Yamaguchi等[58]和Fujita等[59]发现,牙槽骨中基质金属蛋白酶9(metalloproteinase-9,MMP-9)、组织蛋白酶K、整合素αvβ3、RANKL和RANK等破骨细胞相关因子在LLLT作用下得到了显著上调,可有效促进骨改建活动;同时,包括碱性磷酸酶、Runt相关转录因子2在内的多种成骨相关指标的表达在治疗后也得到增强,提示LLLT对牙槽骨修复重建同样有积极作用。研究认为这可能是由以三磷酸腺苷为主的牙周能量代谢水平提高及局部血供增强所造成的。LLLT具有生物安全、使用便捷等优点,对于牙槽骨的改建及修复均有积极作用,具备潜在的临床应用前景。
3. 3 生理磁场干预 磁疗法(magnetotherapy)是指将人造磁场施于机体组织器官,通过磁场对机体生物电流分布及电荷运行状态的影响来产生生物效应和治疗作用的理疗技术,目前已广泛应用于辅助治疗骨折、神经衰弱及颈椎病等多种临床场景中。生理量级的外磁场干预符合生物安全标准,不会对机体造成潜在的副反应。Wang等[60]将小鼠置于不同强度的磁场环境中(2 ~ 4 T、6 ~ 8 T和10 ~ 12 T)维持28 d,通过血液指数、器官系数和组织形态检测,发现适度暴露于可控磁场环境下,不会对小鼠的全身健康造成负面影响。Shan等[61]将接受正畸治疗的小鼠暴露于由汝铁硼磁块构建的强度为20 ~ 200 mT的静磁环境中,发现实验组小鼠表现出更高的牙齿运动速率和更大的累积牙齿移动量[(0.2887 ± 0.0041)mm vs. (0.2114 ± 0.0089)mm];Dogru等[62]利用正弦及脉冲电磁场对正畸大鼠进行每日8 h、强度1.5 mT的刺激,同样发现牙移动速率得到显著提升;在临床研究中,Showkatbakhsh等[63]将需要尖牙移动的患者单侧牙列暴露于局部磁场,使得该侧尖牙获得了0.83 mm的额外牙齿移动增量;Bhad等[64]通过每日8 ~ 10 h的电磁场干预,将患者的牙齿移动速率提高了31%。上述研究说明微磁干预对改善正畸治疗效率具有潜在作用,这种作用一方面是由于局部破骨细胞数量及活性的大幅提升所造成的透明样变区域的快速清除[64];另一方面,也有学者认为,微磁干预激活了FGF及VEGF信号通路,由二者所调控的血管新生及干细胞成骨分化同样促进了牙槽骨的修复改建[65-66]。磁疗技术可对机体产生广泛且积极的生物学效应,但目前有关微磁场调控牙槽骨改建的机制报道相对较少,还需要更多的研究来探索其在正畸辅助治疗中的具体应用方案,解析其促进正畸牙移动及组织改建的内在机制。
4 结语
研发新一代加速正畸牙齿移动技术,提高正畸治疗效率、缩短疗程、减少并发症,是当前口腔正畸领域亟待突破和解决的热点问题。现有的加速正畸牙齿移动技术包括外科干预、药物干预及物理刺激。外科干预对骨改建有一定作用,但会对患者造成明显的疼痛和创伤,临床应用和推广存在难度;药物干预的疗效存在争议,个体差异较大,全身反应明显;物理刺激具有无组织创伤、穿透性高、生物安全及精准可控等特点,适合辅助应用于正畸治疗场景。超声振动疗法已在美国获得FDA批准上市,但近年来多项研究对其临床疗效产生质疑,应用前景不明晰;近红外激光及微磁效应已广泛应用于机体多种疾病的诊断及治疗中,也有研究显示二者对骨组织的修复再生有积极作用。本课题组于前期研究中发现810 nm波段的近红外光刺激可通过调节牙周微环境内多种细胞的能量代谢活动,显著提升牙槽骨改建速率;同时局部微磁场刺激也可有效协同正畸力,大幅提高牙齿移动速率。这些结果提示,以近红外及微磁场干预为代表的物理刺激对正畸牙周组织改建具有潜在的应用价值,深入开展相关的系统性基础及临床研究,推动近红外及微磁干预策略在加速正畸牙齿移动治疗中的临床转化及应用,有望优化错𬌗畸形患者的治疗效果、缩短正畸治疗周期、减少并发症,惠及国内外广大错𬌗畸形病患群体。
参考文献 略

 郑爽牙套照 清纯
郑爽牙套照 清纯 周润发牙齿洁白完
周润发牙齿洁白完 体坛帅哥李小鹏
体坛帅哥李小鹏